2025年3月23日、北海道大学医学部百年記念館にて、第140回サイエンス・カフェ札幌「ワクチン?何それ、おいしいの? 〜経口ワクチンで狂犬病から世界を救え!〜」を開催しました。

本カフェは、「ワクチン開発のための世界トップレベル研究開発拠点の形成事業」の一環として、北海道大学 CoSTEPと北海道大学 総合イノベーション創発機構 ワクチン研究開発拠点 (IVReD)との共同開催です。日本も実は無関係ではいられない狂犬病予防の必要性と、主な発生国である途上国における疾病制御の難しさと重要性について、IVReD特任助教の板倉友香里さんに解説していただきました。この日はあいにくの雨天でしたが、33名が来場しました。


狂犬病は、いまだ治療法が確立されておらず、発症すると致死率ほぼ100%の恐ろしいウイルス感染症です。ですが、ワクチンを接種することで確実に防ぐことができる克服可能な病気でもあります。日本では1950年代から対策を徹底したことで狂犬病の撲滅に成功し、現在は「清浄国」となっています。(狂犬病の症状についてはこちらの記事(https://costep.open-ed.hokudai.ac.jp/like_hokudai/article/33758)もご覧ください。)
一方、国外に目を向けると、アジアとアフリカを中心に今も毎年およそ59,000人が命を落としています。ワクチンによって予防できる病気がここまで多くの死者を出しているのはなぜなのでしょうか?そこには、科学だけでは解決できない社会の問題がありました。
「顧みられない熱帯病」
「顧みられない熱帯病(Neglected Tropical Diseases)」という言葉があります。主に熱帯の途上国を中心に発生し、貧困を理由に十分な対策や研究が進んでいない病気を指します。狂犬病もそのひとつです。日本ではもう過去の病気のイメージすらありますが、実は世界では清浄国のほうが圧倒的に少ないのです。
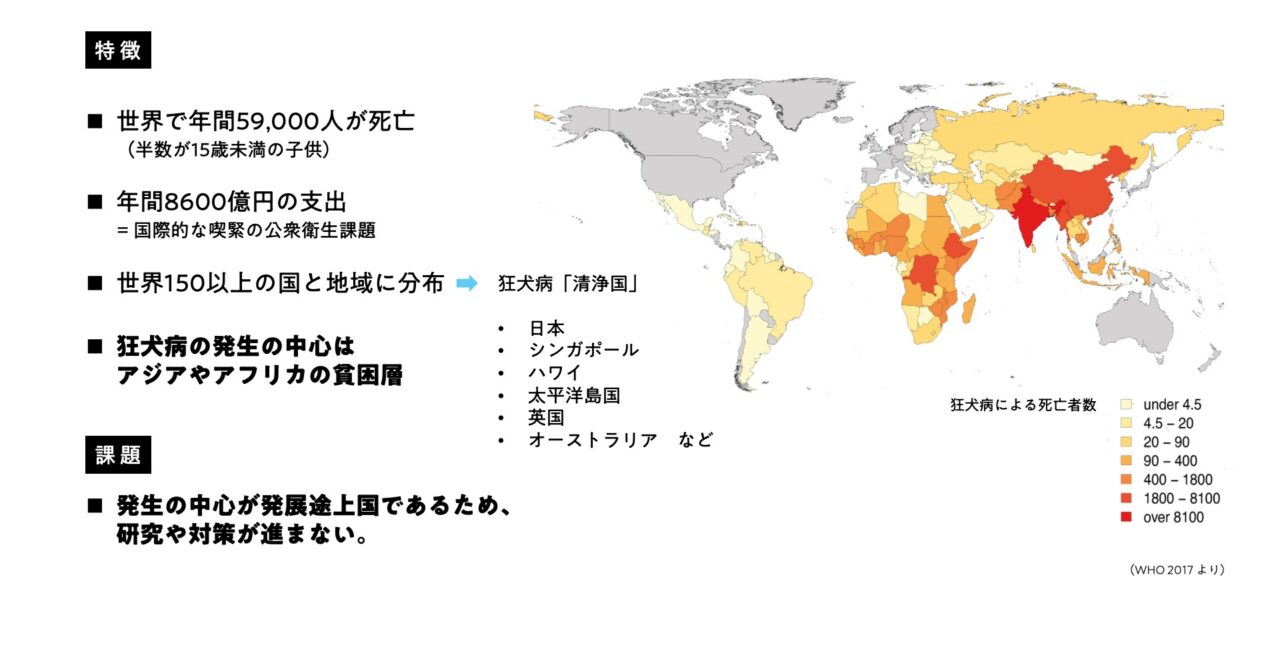
熱帯の貧困地域で狂犬病予防が進まない理由は、大きく分けて2つあります。ひとつは、物流や医療アクセスが悪く「ワクチン接種が行き届かない」こと。もうひとつは、媒介者となる「野犬の数がとても多い」ことです。
現在使われているワクチンは「生ワクチン」のため冷蔵保存が必須ですが、貧困地域ではコールドチェーンも保管施設も確保できません。また病院までの距離がとても遠かったり、医療人材も不足しているため、人間にも動物にも継続的な接種ができない現状があります。またヒト狂犬病の99%はイヌ由来です。狂犬病の拡大を防ぐには野犬の集団内で70%以上のワクチン接種率を達成する必要があるといわれていますが、何万頭もいる野犬を毎年捕獲して注射をするのはとても現実的ではありません。

狂犬病が拡大していくしくみ
さらに、狂犬病は感染から発症までの潜伏期間が長く(通常は1〜3ヶ月だが1年以上かかる場合も)、感染した動物がその間に広範囲に移動し、そこで新たな感染を引き起こします。通常、致死性の高い感染症はすぐに感染した動物を殺してしまうためあまり拡大できないものですが、狂犬病はこの長い潜伏期間によって広範囲に分布域を拡大することができるのです。
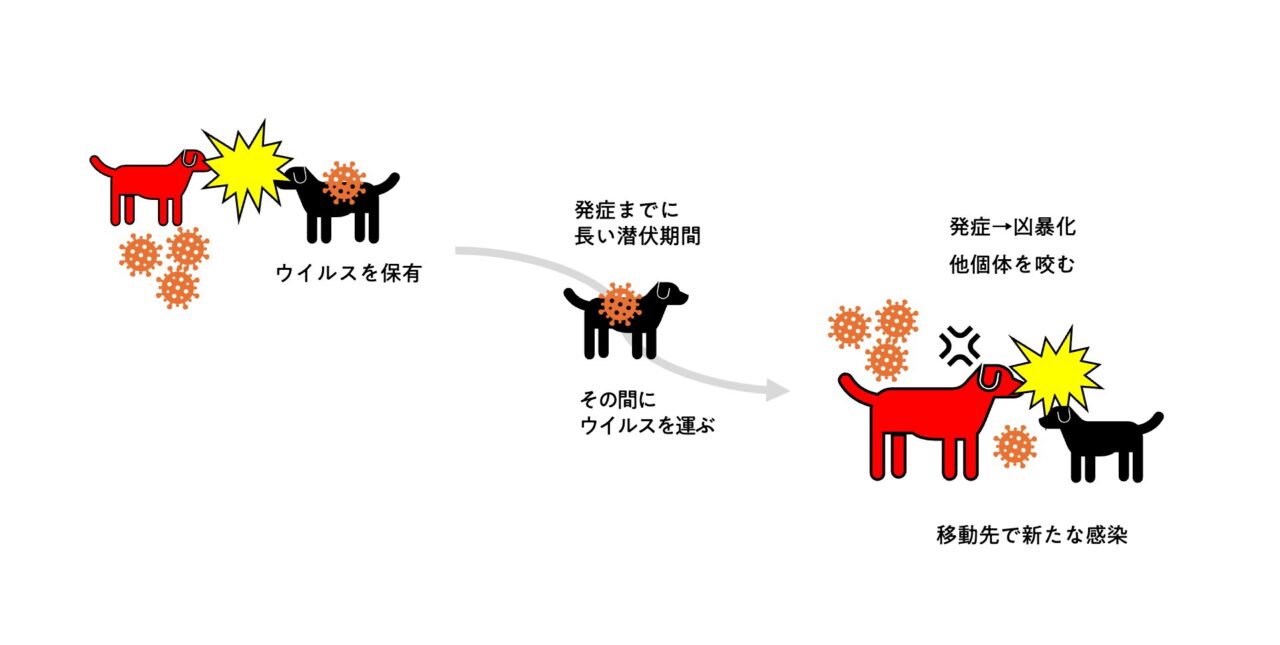
日本で狂犬病を撲滅することができたのは、飼い犬へのワクチン接種と野犬駆除を徹底した成果ではありますが、同時に島国であることも関係しているでしょう。しかし、物流や人の移動が盛んな現代では、日本も絶対に安全とは言えないかもしれません。
「経口ワクチン」が解決の鍵に
このように、人間への狂犬病感染予防のためには野犬へのワクチン接種が必要となりますが、こうした貧困地域での対策の難しさを解決するべく開発されているのが「経口ワクチン」です。従来の注射タイプではなく、餌のなかに液状の生ワクチンが内包されたもので、実はすでにヨーロッパでは、主に野生のキツネに対して非常に広範囲に効果が証明されています(こちらの記事(https://costep.open-ed.hokudai.ac.jp/like_hokudai/article/33758)もご覧ください。)。餌タイプなので「ベイト(「餌」の意)ワクチン」とも呼ばれます。
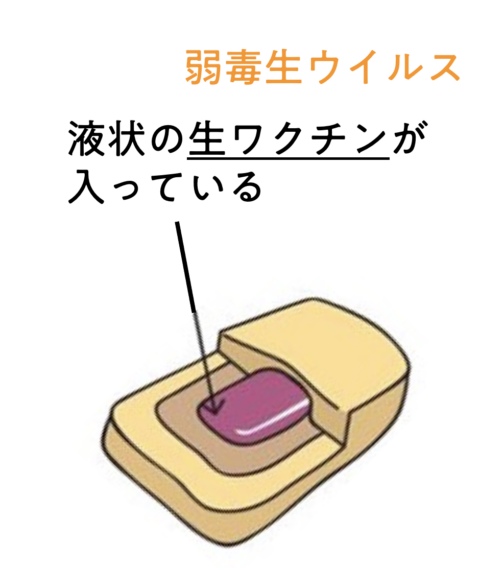
この方法を使えば、貧困地域にすむ野犬に対して広範囲にワクチン接種をすることができそうです。
しかし、この方法にはまたひとつ問題があるのです。
生のウイルスを使った経口ワクチンの問題点と打開策
従来型の狂犬病経口ワクチンには弱毒化されているとはいえ感染性のあるウイルスが使われています。野犬の生息域は人間の生活エリアと重なっているため、村や町に経口ワクチンを散布することになりますが、感染性のあるものを人間がすむ場所に大規模に散布することは認められていません。
そこで、板倉さんは感染性ウイルスを使わない経口ワクチンの開発に取り組んでいます。求められるのは、人が住む場所でも使える安全性と、医療環境や保管設備がなくても誰でも使える簡便さです。
しかし今度は、感染性ウイルスを使わないことで科学的な課題が生じました。

感染性ウイルスを使わないことで生じる課題と新しい機構
感染性ウイルスを使わないということは、動物の体のなかで増殖していかないため、ワクチン抗原が胃酸や消化酵素で分解されてしまい、うまく免疫が誘導されないのです。また、抗原が分解されなかったとしても、抗原を体の中の免疫細胞まで届ける効率が低くなると考えられます。そこで板倉さんは、①ワクチン抗原を消化から守ることと、②ワクチン抗原を持続的に発現させることを目指して、ワクチン抗原を産生する新たなシステムをつくることにしました。
① ワクチン抗原を消化から守る作戦
まず、口から入ったワクチン抗原が消化されずに済むための方法として、「ジアルジア」という寄生虫の体表面のタンパク質(Variant Surface Protein; VSP)を失敬します。もちろん、ジアルジアの病原性の部分は取り除かれ、VSPだけを発現するように設計します。
② ワクチン抗原を持続的に発現させるための作戦
また、動物の体に感染しなくてもワクチン抗原だけを増殖させるために、「レプリコン(自立増殖型RNA)」を使います。
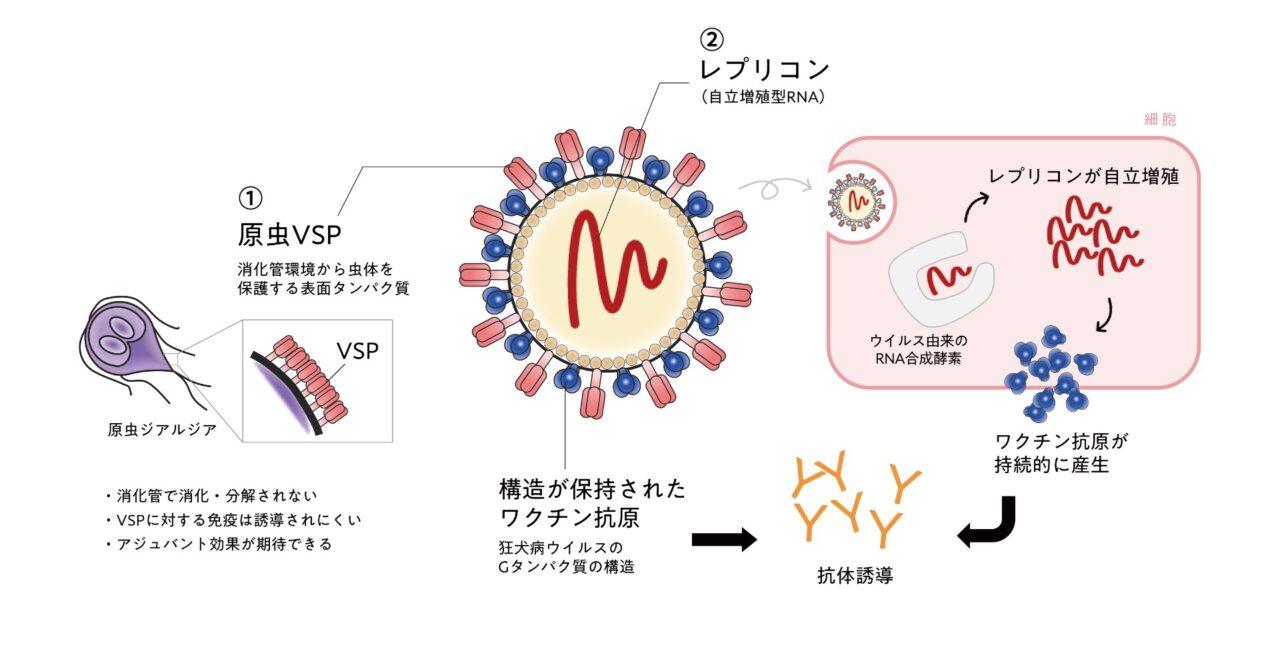
さらに、狂犬病ウイルスの「Gタンパク質」と呼ばれる突起(この部分が感染した動物の細胞膜に取り付いて侵入していく)と似た構造で設計することで、より抗体誘導しやすい工夫をしています。
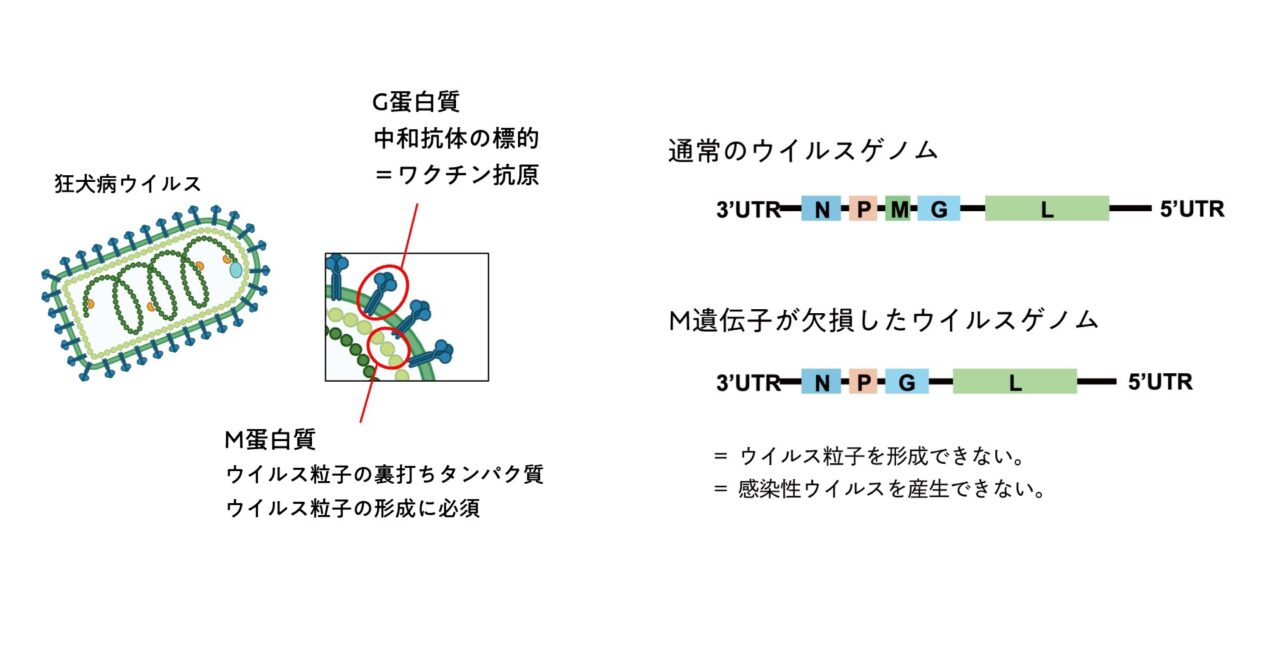

また、通常の狂犬病ウイルスには「Mタンパク質」と呼ばれる、ウイルス粒子の形成に必須のタンパク質がありますが、板倉さんが作製する新しい機構ではこれを取り除くことで粒子を形成できないようにしています。これで、感染性ウイルスは産生できなくなり、ウイルス抗原だけを産出できるというわけです。

経口ワクチン開発、次の一手
板倉さんは現在、マウスを使って実験しています。作製した新しいワクチン抗原産生機構を「ゾンデ」と呼ばれる器具で口から胃に届けるのですが、実は今ここでまた問題が発生しているそうです。マウスには扁桃がないのです!口からの摂取を想定しているので、本来は体の中に一番最初にワクチン抗原が到達する扁桃(免疫細胞が多く発現する場所)での免疫応答を評価したいところです。そのため、次は扁桃を持つ「スンクス(ジャコウネズミ)」という実験動物を使うことにしています。
また、先ほど紹介した寄生虫の表面タンパク質(VSP)の搭載と、さらにワクチン抗原となるGタンパク質の発現効率をもっと高める方法を開発していくそうです。

板倉さんのめざすもの
最後に板倉さんは、学生時代にウガンダでの狂犬病ワクチン接種(従来の注射タイプ)のボランティア活動に参加したときのエピソードを紹介してくださいました。イギリスの「Mission Rabies」という団体に同行して村を回り、飼い主と交流しながら8日間で2715頭のイヌと19頭のネコにワクチン接種をして回ったそうです。動物を飼うことの意味が日本とは大きく異なる貧困地域において、ワクチン接種だけでなく、正しいイヌの飼育の仕方や接し方を飼い主に伝えることの大切さと難しさを実感したといいます。

科学だけでは解決できない社会的な問題をはらむ課題に挑むとき、研究と社会とのつながりを考え続けることが求められます。遠い国の話から始まった今回のカフェでしたが、最後は私たちも全く無関係ではいられないことがじんわりと伝わるお話でした。板倉さん、ありがとうございました。

※ 会場から質問をたくさんいただきました。記事冒頭の動画で全て見ることができますので、どうぞお楽しみください。

(当日配布したパンフレット。左:外面、右:内面)

