2012年1月21日(土)に開催した第61回サイエンス・カフェ札幌 『「くすり」よ届け。〜ナノサイズ船細胞の宇宙を行く〜』は、たくさんの方にご来場いただきました。(当日のカフェレポートはコチラ)
当日は50を超える質問をお寄せいただきましたが、短い時間内では十分にお答えすることができませんでした。質問件数の多かったものを中心に、秋田先生にお答えいただきました。
_________________________________________
■「くすり」の働きに関する質問
Q1:くすりはどのような形で体内に取り込まれるのですか?(カプセルとか点滴とか)
皆さんがよく使われている薬の多くは口から飲む薬が多いと思いますが(経口投与)、遺伝子を「くすり」として用いる場合、臨床試験などで行われている投与方法の多くは、筋肉などの局所に直接投与するものや、生体内から細胞を取り出して、試験管内で遺伝子を導入し、その細胞を体の中に戻す方法などがあげられます。私たちも、これらの投与経路を想定して実用化などをめざしていますが、さらに将来を見据え、注射によって血液中に投与する方法(静脈内投与)にも研究を進めています。カフェでは、船を細胞内にいれて、どうやって核まで運ぶか?というお話をしました。血液から投与した場合を考えると、その前段階として、どうやったら「くすり」を運ぶ船を血液中に安定に存在させることができるか。また、どうやって患部に届けるか(標的化するか)?というような、さらなる課題も克服することが必要になります。この技術は困難ですが、なんとか革新的な技術を創製したいと、日々研究を続けています。
Q2.膜融合はどういう仕組みで起きるのでしょうか? またそのトリガーは?
膜というのは、厳密にいうと、脂質と呼ばれるものからできています。脂質は、その一つの分子の中に水に溶けやすい部分と溶けにくい部分を持つ分子で、これらの領域の空間的な大きさ(かさだかさ)などで、膜融合性が起きやすい、起きにくいなどが決まっています。ただ、厳密に、細胞膜や核膜など、どのような脂質が融合しやすいのか?という問いに関しまして、その理論や法則性に関しては、答えがまだありません。
トリガーという点に関しては、先日のカフェではお伝えできませんでしたが、細胞の中の環境を利用して融合活性のオン、オフを制御しています。具体的には、細胞の中の局所的な酸性度を利用しています。遺伝子を運ぶ船は、細胞の中に小胞に取り込まれる形で侵入しますが、小胞の中は酸性(H+イオンが多い環境)になっています。この環境をうまく利用すれば、小胞の中に入ってからはじめて膜融合活性が高まる設計ができるようになります。
Q3.核内に入った遺伝子は染色体や遺伝子にどのように取り込まれ、どのように働くのですか?
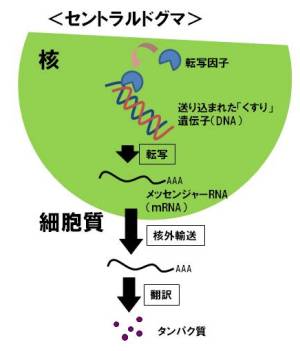 遺伝子が機能するためには、船が核に到達した細胞の力を借りる必要があります。遺伝子が機能するということは、送り込んだ遺伝子に書かれたタンパク質の設計図が正しく読まれ、最終的にはタンパク質ができるということです。
遺伝子が機能するためには、船が核に到達した細胞の力を借りる必要があります。遺伝子が機能するということは、送り込んだ遺伝子に書かれたタンパク質の設計図が正しく読まれ、最終的にはタンパク質ができるということです。
送り込む遺伝子は、DNAとよばれるものですが、タンパク質ができるまでには、まず細胞内の核内にある転写因子とよばれるたんぱく質(これは、細胞の中にあります)が結合し、メッセンジャーRNA(mRNA)という中間体分子に情報が写しとられます(これを転写といいます)。このmRNAは、核から細胞質のほうに輸送され、このmRNA情報に基づいて細胞質でタンパク質が作られます(この過程は翻訳といいます)。このように、核内の遺伝子からmRNAに転写され、またタンパク質まで翻訳される過程は「セントラルドグマ」と呼ばれています。生物学をこれから学ぶ方々は一番初めに習うと思いますので、参考にしていただければと思います。
Q4.このくすりを使うことにより想定される弊害はありますか?
私たちが作る船は、極力人工的な材料をもちいて、ウイルス由来のものはなるべく持たないように設計したいと考えています。これは、ウイルスの持つ免疫原性を回避するための設計です。ただ、場合によっては、設計した材料が何らかの毒性をしめす可能性もありますので、材料の安全性は、慎重に調べる必要があります。
また、遺伝子を「くすり」として使う上では、送った遺伝子が、もともと私たちのもつ遺伝子(染色体遺伝子)の中に組み込まれる場合も想定されます。染色体DNAの中に挿入されると、染色体ごと導入した遺伝子が複製されていきますので、細胞の分裂とともに長期にわたって導入した遺伝子が維持されていくという長所があります。しかし、遺伝子がよくない部分に挿入されてしまった場合、思わぬ毒性を示してしまう可能性もあります。ゲノム遺伝子の中に外来の送り込んだ遺伝子を組み込むべきか、それとも組み込まないほうが良いのか。対象とする疾患にもよりますので、どちらが良いかという点もはっきりした答えは出ていません。今、両方の観点から世界中で開発がすすめられています。私たちの研究室では、基本的にゲノム遺伝子の中には組み込まない方向で研究を進めています。
Q5.抗ガン剤との併用、免疫細胞療法とのちがいは?
癌を遺伝子治療で克服することを想定したとき、抗がん剤やサイトカイン製剤などの既存の薬との併用は有用だと思います。実際、動物実験でも、両者の併用で腫瘍の増殖がより強く抑えられるという研究報告は多くあります。
また、今回のカフェの最後に、DNAワクチンのお話もさせていただきました。今の免疫細胞療法(タンパクワクチン)との大きな違いは重要なポイントです。腫瘍の抗原は、個々の患者さんによって個性があります。また、よく新型インフルエンザなどという言葉も耳にすることもあるかと思いますが、ウイルスの抗原は高い頻度で変異してしまいます。これまでのタンパクワクチンは、タンパクの合成、精製に多くの手間と時間を要するために、変異の高いウイルス抗原や、多様性のある腫瘍抗原に対応するのが困難です。DNAワクチンは、導入する遺伝子の情報を変えるだけで、原理的にはこれらの抗原に素早く対応可能という点で、次世代のワクチンとして期待されています。
■「くすり」の作り方について
Q6.具体的には船はどうやって作るのですか?
現在、いろいろな原理に基づいて多重膜のものから、1枚膜のもの、さらには、2種の膜でコーティングされたものなどが開発されています。基本的な原理は、プラスイオンとマイナスイオンの間の静電的な相互作用に基づいています。遺伝子はマイナスのイオンを帯びている長い鎖状の分子です。ここに、プラスのイオンを帯びた別の長い分子を混ぜると、プラスとマイナスの電気がひきつけあい、さらに、両者がお互い紐同士が絡まるようにして、小さな粒子ができます。この粒子の表面も、プラス、あるいは、マイナスの電荷を帯びています。この粒子を、反対のイオンを持つ脂質の膜の上に入れ、超音波などで力を与えることで、膜と粒子が引き付けあいながら、粒子を膜で包み込むことが可能となります。
Q7.ひとつの船にはどれくらいの遺伝子が入っているのですか?
遺伝子が船の中にいくつ入っているかを測定するということは非常に難しい技術になりますので、明確な答えは持っていません。ただ、やはり粒子の中にもいくつもの遺伝子が入っているのではないかと考えています。ある粒子の中には2つ入っていて、別の粒子には3つ入っているなどの状況が起きてしまうと、粒子の大きさも不均一になってしまいます。そこで、遺伝子は1粒子に1つずつ均一に封入することができれば、粒子の均一性を高めるためにも重要と考えています。私たちは、いかにして一遺伝子ずつ粒子にくるむかという技術開発も進めています。
Q8.船の膜を増やすことでコストが上がったりしませんか?
膜を形成するために必要な脂質という分子自身、それほどコストはかかりません。ただ、多重化などの操作が複雑になればなるほど、そのための時間などは多くかかってしまうと思います。いかに大量に、さらになるべくシンプルかつ均一につくるかという点は、今の研究室レベルから実用化研究へ発展させるためのプロセスとして重要と思います。
Q9.膜のプラスの物質とはなんですか?
私たちの体を形成するタンパク質は、アミノ酸というものが連なってできています。アミノ酸にもいろいろ種類があり、アルギニンやリジンなどは、プラスのイオンを有するアミノ酸です。このアミノ酸をいくつかつなげた短い鎖などを粒子の表面に修飾することによって、表面をプラスにすることができます。
■薬学一般について
Q10.薬学部を志望する高校生で、物理化学で受験した生徒は、生物を履修していなくても大丈夫でしょうか?
北海道大学のオープンキャンパスに来られた高校生や父母の方々からも同じような質問を何度かされたことがあります。御質問に端的に答えると、履修していなくても大丈夫です。私も高校では物理でしたが、大学から生物を勉強しても十分だとおもいます。それだけ、今では新聞などでも多く生物の話題にあふれています。勉強していて、聞いたことがあるという言葉も多いと思いますので、比較的早くなじめるのではないでしょうか。
Q11.40年前の薬学のイメージと全く違う。新薬開発の現状について教えてください(世界的に頭打ちと聞いたが・・・)。
歴史を紐解くと、1805年、ドイツの薬剤師ゼルチュルナーが初めて阿片からモルヒネの抽出・結晶化に成功したことから、薬の歴史は大きく動きました。その後、この19世紀は有機化学が発展し、合成された有機化合物を医薬へと利用する試みがなされてきました。今でも皆様が使用されている薬のほとんどは低分子薬物かと思います。御質問にありました、世界的に頭打ちという表現ですが、もしかすると、テレビなどで時々耳にする「2010年問題」に起因することとお察しします。これは、1990 年代後半に販売された大型医薬品が、2010 年前後に続々と特許切れを迎えるという問題です。特許がきれると、安価な後発医薬品(以下ジェネリック)にシェアを奪われて大幅に売上げが落ち込む可能性が高く、新薬メーカーにとっては、厳しい経営環境となることが予想されています。
新しい薬についても、現在多くの研究が各企業で行われていますが、新薬開発という観点からは、大きなパラダイムシフトがおきているといっても過言ではありません。また少し時間は戻りますが、20世紀は、分子生物学が誕生し、疾患の原因が分子レベルで解明される時代となりました。特に、1953年4月、ジェームス・ワトソンとフランシス・クリック(1962年ノーベル生理学・医学賞受賞)の連名でNature誌に掲載されたDNAの構造に関する論文は、その後のDNAを中心とした分子生物学の幕開けの原動力となりました。これにより、これまでに多くの酵素やホルモンが高分子医薬品として開発されてきた。糖尿病治療に使用されるインスリンもその一つです。また、1975年にマウスモノクローナル抗体作製技術が確立され、抗体を利用した分子標的薬の開発が進みました。抗体医薬は現在のブロックバスター(年商10億ドル(約1000億円)を超える新薬)の大部分を占め、現在、世界の売上ランキングのトップ10にも多く挙げられています。
1950年代に幕を開けた分子生物学の劇的な変遷に伴い、バイオ医薬は従来からの低分子化合物だけでなく、抗体やサイトカイン、遺伝子、核酸などの多岐にわたる高分子へと広がりを見せているのが現状です。

